《人类遗传资源管理条例实施细则(征求意见稿)》
及我国人遗资源监管机制评析
2022-03-23

前言���:
科技部于2022/3/22发布《人类遗传资源管理条例实施细则(征求意见稿)》(以下简称���:意见稿)���,旨在确保人遗条例各项规定的落实���,进一步提高我国人类资源管理效能。本文将对意见稿规定的主要内容及事项进行分析���,同时梳理我国人遗资源监管的基本机制。
自2019年6月国务院颁布《中国人类遗传资源管理条例》(以下简称���:人遗条例)以来���,随着“三医”领域改革措施的进一步落地���,创新药license in和license out带来的国际合作的增多���、真实世界数据研究与医疗大健康数据开发利用���、涉及人的生物医学研究伦理问题的凸显等问题���,均对我国人遗资源的监管提出更高要求。同时���,近几年我国在生物安全���、数据安全与个人信息保护���、科技进步���、人类生物样本管理等领域密集出台相关法律法规���、政策和标准���,也构成我国人遗资源监管法律法规体系的有效组成部分。
我们认为���,在此背景下制定的意见稿主要有以下内容或亮点���:
一���、 充分吸收近年生物安全���、数据安全与个人信息保护���、科技进步���、人类样本库管理等领域的立法成果
1.衔接《民法典》���、《个人信息保护法》关于隐私权和个人信息知情保护的规定
意见稿第9条规定���,采集���、保藏���、利用���、对外提供我国人类遗传资源应当尊重人类遗传资源提供者的隐私权���,事先取得知情同意���,确保提供者健康并保护其合法权益。
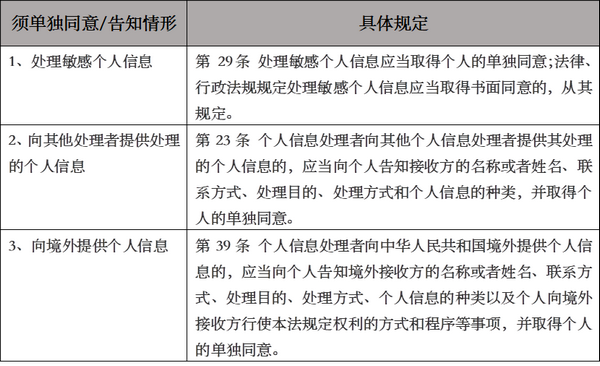
鉴于《民法典》对于隐私权���、《个人信息保护法》对个人信息采集���、处理的知情同意均有明确规定���,因此科研机构���、高等学校���、医疗机构和企业等主体对人遗资源的采集���、保藏���、利用和对外提供应当同时遵守上述规定。如针对保护提供者隐私权���,《民法典》1032条规定自然人享有隐私权���,任何组织或者个人不得以刺探���、侵扰���、泄露���、公开等方式侵害他人的隐私权。再如针对“应取得个人的单独同意”的情形���,《个人信息保护法》相关规定如下���:
2.衔接科研领域���、人类生物样本库相关标准���、指南和规范
意见稿第10条规定���,采集���、保藏���、利用���、对外提供我国人类遗传资源���,应当遵守科研活动的相关要求及技术规范���,包括但不限于标准���、规范���、规程等。该条是对《人遗条例》第9条“采集���、保藏���、利用���、对外提供我国人类遗传资源���,应当遵守国务院科学技术行政部门制定的技术规范”的细化和完善���,即科研活动相关的标准���、规范���、规程不再局限于科技部门制定的技术规范���,如《涉及人的生物医学研究伦理审查办法》���、《药物临床试验质量管理规范》(2020版)���、《用于产生真实世界证据的真实世界数据指导原则(试行)》等均应作为人遗监管法规规范的组成部分。
同时���,意见稿第35条“保藏许可条件”中有“具有负责人类遗传资源管理的部门和保藏管理制度”���、“具有符合国家人类遗传资源保藏技术规范和要求的场所���、设施���、设备和人员”的要求���,32条“采集许可条件”亦有类似规定。结合当前法规规范���,上述管理制度���、技术规范以及场地���、设施等标准当主要索引国家市场监督管理总局���、国家标准化委员会颁布的《生物样本库质量与能力通用要求》(GB/T 37864)���、《人类生物样本库管理规范》(GB/T39766-2021)等规定。
3.吸收《科技进步法》���、《数据安全法》相关规定及真实世界数据研究等机制
意见稿第20条“保藏基础平台和数据库建设”规定���,科技部会同国务院有关部门及省级科技部门推进标准化���、规范化的人类遗传资源保藏基础平台和大数据建设���,并依照国家有关规定向有关科研机构���、高等学校���、医疗机构���、企业开放。第24至28条对科技部门进行人遗调查���、重要人类遗传资源登记等进行规定。
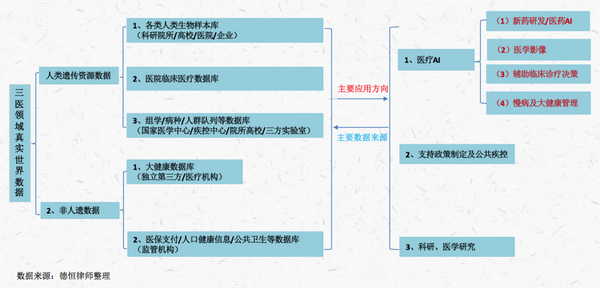
上述规定旨在搭建我国人遗资源基础平台和数据库���,在此基础上展开相关应用以达到“合理利用人类遗传资源开展科学研究���、发展生物医药产业���、提高诊疗技术���,提高我国生物安全保障能力���,提升人民健康保障水平”的目的���,其应用如下图���:
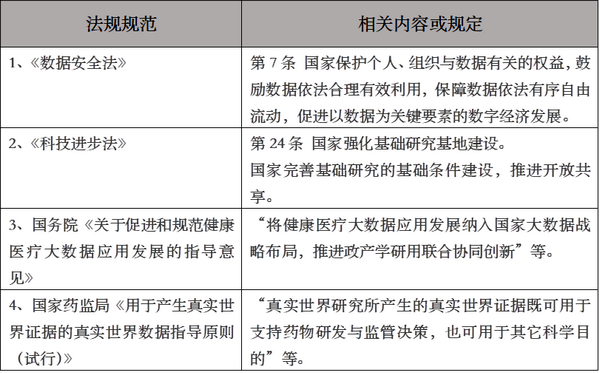
与上述规定勾稽的现行法规���、规范至少如下���:
综上���,本次意见稿通过吸收���、索引近几年多个关联领域的立法成果���,丰富了我国人遗监管法规体系。
二���、明确操作标准���,优化相关程序���,提升人遗监管的确定性和效率
1.明确”外方单位“的具体标准
针对实务中理解不一的“外方单位”问题���,意见稿第12条规定���,境外组织及境外组织���、个人“实际控制情形”包括���:(1)境外组织���、个人持有或者间接持有机构50%以上的股份���、股权���、表决权���、财产份额或者其他类似权益;(2)境外组织���、个人持有或者间接持有机构的股份���、股权���、表决权���、财产份额或者其他类似权益虽然未达到50%���,但其所享有的决策机构表决权或其他权益足以对该机构的决议或对该机构的决策���、内部管理产生重大影响;(3)境外组织���、个人通过协议或者其他安排���,足以对机构的决策���、经营管理等重大事项施加重大影响;(4)科技部认定的其他情形。
值得关注的是���,上述“境外组织���、个人通过协议或其他安排���,足以对机构的决策���、经营管理等重大事项施加重大影响”当包含VIE情形���,也即若本版意见稿一旦实施���,通过搭建VIE结构在境外上市的相关公司将被认定为为“外方单位”���,这将对我国现有人遗监管业态和资本市场带来较大变化。
2.进一步明确采集许可���、保藏活动的具体范围���,厘清监管口径
意见稿第31条规定���,在原有指南中增加“高血压���、糖尿病等常见多基因疾病的人类遗传资源采集不在此列”的规定。同时将科技部采集许可指南中规定的“累计500例”修改为“用于大规模人群研究3000例以上的采集活动。大规模人群研究包括但不限于队列研究���、横断面研究���、临床研究���、体质学研究等。为获得相关药品和医疗器械在我国上市许可的临床研究涉及的采集活动不在此列”。
意见稿第34条规定���,保藏活动是指将来源合法的人类遗传资源保存在适宜环境条件下���,保证其质量和安全���,用于未来科学研究的行为���,不包括以教学为目的���、在实验室检测后按照法律���、法规要求或临床研究方案约定的临时存储行为。这一规定也与科技部中国人类遗传资源管理办公室于2022/3/4发布的《人类遗传资源管理常见问题解答》(以下简称���:人遗问答)中“样本如需长期存放则应存储于获批的保藏库”的口径相一致。
同时���,意见稿在第37条增加保藏许可豁免情形���,即符合保藏许可申报的事项���,无需另行申请采集许可。
3.明确保藏年度报告���、国际合作情况报告的具体内容���,便于实施
意见稿第38条规定���,保藏单位应于每年3月31日前向科技部提交上一年度本单位保藏人类遗传资源情况的年度报告���,并抄送省级科技部门。年度报告应当包含以下内容���:(1)保藏的人类遗传资源情况;(2)人类遗传资源来源信息和使用信息;(3)执行保藏人类遗传资源相关管理制度情况;(4)本单位用于保藏人类遗传资源的场所���、设施���、设备的维护和变动情况;(5)本单位负责保藏工作人员变动情况。科技部组织省级科技部门每5年对其保藏活动进行检查。另外意见稿第44条对国际合作研究情况报告的内容进行详列。
4.针对外方伦理批件提供难的问题���,增加外方伦理审查豁免情形
意见稿第40条“国际合作许可条件”中规定���,经中方合作机构伦理委员会审查���,认为申请人类遗传资源国际合作许可���、备案���,不涉及重大伦理问题���,且确实无法提供外方伦理审查的可以豁免外方伦理审查。该条另就申请外方豁免伦理审查应满足的条件及要求作出规定。
上述规定应是对鼓励国际合作���、加快境外已批准或上市的药物的引进的机制性呼应。
5.细化对外提供或开放备案���、备份内容���,明确人遗信息安全审查的具体情形
意见稿第47条“对外提供备案内容”规定���,备案材料应当包含对外提供或者开放使用我国人类遗传资源基因���、基因组信息的目的���、用途���,向外方单位提供或者开放使用的人类遗传资源基因���、基因组信息等信息。
结合人遗问答规定���,人遗信息的出境区分实时出境信息和非实时出境信息。对于实时出境信息���,如涉及基因数据信息���,应将拟出境数据信息类型���、合计例数���、单位/规格等进行数据备份���,并预估整个项目的数据量进行数据备案���,备案通过后定期进行数据备份;如不涉及基因数据信息���,不需要进行信息备份和备案。非实时的人遗信息的出境���,按备案备份基本制度管理。同时���,人遗问答进一步明确论文和会议情形下的数据出境备案备份机制。
意见稿第48���、49条规定对外提供或者开放使用以下信息应当通过科技部组织的安全审查���:(1)重要遗传家系的人类遗传资源信息;(2)特定地区的人类遗传资源信息;(3)500人以上人群的外显子组测序���、基因组测序信息资源等。在安全审查的具体程序上���,意见稿第50条规定���,科技部会同相关部门制定安全审查原则���,组织相关领域专家进行安全审查评估���,并根据专家安全审查评估意见做出决定。这一规定也与相关数据安全法规中数据安全审查机制的规定保持一致。
6.明确国际合作的重大和非重大变更的具体情形
意见稿第61条规定国际合作中应当向科技部申请变更许可的重大变更情形包括���:申办方���、组长单位���、合同研究组织���、第三方实验室发生变更的���,研究目的发生变更的���,研究内容发生变更的���,合作期限等重大事项发生变更的;同时意见稿62条对“国际合作许可的非重大变更”情形作出规定���,便于相关主体执行。
7.优化审批/备案制度和流程���,提升人遗监管的确定性和效率
意见稿第19条规定���,科技部应当加强人类遗传资源管理信息系统建设���,方便申报人或申请人利用互联网办理申报登记���、行政许可���、备案等事项���,推进网上实时动态管理���,实现人类遗传资源管理信息可记录���、可追溯���、可查询。
第23条增设“沟通交流”机制���,规定相关单位在行政审批申请前���、开展相关获批事项活动过程中以及相关信息备份备案等阶段���,可以就重大问题与生物中心进行沟通交流。生物中心可以根据工作需要组织与申请人进行沟通交流。
第69条增设快速审批机制���,规定针对发生突发公共卫生事件等突发事件���,在行政应急中需要人类遗传资源行政许可的���,可加快评审审批。
上述规定旨在提升人遗审批的的透明度���,提升人遗监管的确定性和效率。
三���、多举措强化人遗领域的监管和执法力度
1.明确加强人遗传监管执法力量建设
意见稿第五条规定加强人类遗传资源监管力量���,配备执法检查人员���,必要时可以聘任执法辅助人员���,以便科技部和省级科技部门依法履行人遗资源监管职责。
2.细化监督检查机制
在监督检查事项方面���,意见稿第72条进行细化明确���,主要包括���:(1)人类遗传资源采集���、保藏���、利用���、对外提供有关单位落实主体责任���,建立���、完善并执行有关规章制度的情况;(2)获批人类遗传资源项目的有关单位采集���、保藏���、实际使用人类遗传资源的情况;(3)样本或数据信息出境���、对外提供���、开放使用及出境后使用情况���、剩余样本处置情况���、知识产权分享与取得成果等情况;(4)人类遗传资源备案事项的真实性等情况等。
在监督检查机制方面���,设置了编制年度监督检查计划���、重点监督检查���、随机监督检查���,以及遇有严重违法行为或临时性���、突发性任务及通过投诉举报���、转办交办���、数据监测等发现问题时部署的专项监督检查等机制。
3.设置行政处罚主体转移���、委托等机制���,确保监管不缺失
意见稿通过职能管辖与地域管辖(第85条)���、管辖权转移(第88条)���、行政处罚委托(第89条)���、行政执法监督(第90条)等机制���,对人遗条例第36条���、39条���、40条等明确了处罚主体为省级科技部门或科技部的规定构成有效补充���,确保对我国各地方人遗问题的监管能够落到实处。
4.在人遗违法违规行为的处罚监管上���,意见稿详细规定了处罚的种类���、立案���、对涉嫌违法行为的处理���、处罚事先告知���、听证程序等流程���,并专设“行刑衔接”条款。
综上���,上述加强执法力量���、细化监督检查机制���、公开监管程序等措施���,体现了监管部门加强我国人遗监管的明确倾向。
结语���:
当前人遗资源和人类生物样本库已成为医药���、医疗领域的核心基础要素资源���,将在医药研发���、生命科学研究���、转化医学���、医疗健康政策制定等领域发挥基础平台作用。我国人遗资源监管缺口仍然偏大���,以人遗资源保藏为例���,目前保藏许可集中在医院���、科研机构/高校和部分承担公共平台职能企业的样本库或数据库���,大量企业级细胞和组织储存库���、生物样本库尚游离在人遗监管之外���,未来此类人类生物样本库的监管口径有待厘清。
同时���,2022年1月国家卫健委发布《医疗卫生机构科研用人类生物样本管理暂行办法(征求意见稿)》���、2022年3月中办国发布《关于加强科技伦理治理的意见》���,可以预见我国加强人遗资源监管的逻辑持续不变。
本文作者���:
声明���:
本文由k8凯发天生赢家·一触即发律师事务所律师原创���,仅代表作者本人观点���,不得视为k8凯发天生赢家·一触即发律师事务所或其律师出具的正式法律意见或建议。如需转载或引用本文的任何内容���,请注明出处。
