诱导多能干细胞(IPSC)技术及转化���、
应用核心法律机制与问题研究(上篇)
2022-06-06

前言���:
因具有多向分化潜能和体外无限扩增潜力���,且与胚胎干细胞相比���,受法律伦理���、细胞来源限制较少���,近年来我国诱导多能干细胞(IPSC)的相关研究与专利申请明显增多���,应用方向与形态不断扩容���,而相关立法和监管则相对滞后。叠加近几年我国“三医”领域系列改革���,以及生物安全���、人遗监管���、细胞与基因治疗等领域法规体系的不断建立与完善���,亟需厘清相关法律事项的监管架构及口径。
本文拟结合我国干细胞现有业态���,对IPSC产业上游采集与收集���、中游制备和下游转化���、应用过程中涉及的核心法律问题进行系统分析���,以供业界参考。
一���、IPSC成体细胞来源及相关人遗���、伦理问题
(一)IPSC原材料采集来源总览
根据《人类遗传资源管理条例》(以下简称���:人遗条例)第3条的规定���,采集���、保藏器官���、组织���、细胞等人体物质及开展相关活动���,除纳入人遗条例监管的部分外���,还包括依照相关法律���、行政法规规定执行的“为临床诊疗���、采供血服务���、查处违法犯罪���、兴奋剂检测和殡葬等活动”。
在实务中���,科研机构及相关企业较少从司法鉴定���、兴奋剂检测和殡葬等采集途径获得IPSC原材料。2016年中国生物协会发布的《干细胞制剂制备质量管理自律规范》(以下简称���:干细胞自律规范)第21条也明确规定���,“采集机构应是取得《医疗机构执业许可证》的具有供者筛查能力的医疗机构”���,“制备机构应对采集机构或提供机构的资质进行确认���,并定期进行评估”。
关于“医疗机构”的界定���,根据《医疗机构管理条例》第2条���、《医疗机构管理条例实施细则》第3条���、《医疗卫生机构科研用人类生物样本管理暂行办法(征求意见稿)》第3条等规定���,广义的医疗卫生机构包括从事疾病诊断���、治疗活动的医院���、卫生院���、疗养院���、门诊部���、诊所���、卫生所(室)���、急救站���、临床检验中心���、护理院���、医学检验实验室等各级各类医疗机构���,以及疾病预防控制机构���、妇幼保健机构���、采供血机构等。
综上���,从人遗资源采集监管的角度���,IPSC原材料可能的采集渠道如下���:

(二)IPSC原材料的收集来源总览
从行业当前业态看���,IPSC用成体细胞的收集来源主要包括各类成体干细胞库���、医疗机构样本库以及各类机构人遗资源库等。
1.各类成体干细胞库
根据《干细胞制剂质量控制及临床前研究指导原则(试行)》规定���,成体干细胞包括自体或异体���、胎儿或成人不同分化组织���,以及发育相伴随的组织来源的造血干细胞���、间充质干细胞���、各种类型的祖细胞或前体细胞等���,涉及的组织样本包括羊水样本���、新生儿脐带���、脐带血和胎盘样本���、人类骨髓液样本���、牙齿样本���、经血样本���、人类脂肪组织���、滑膜组织和宫内膜组织样本等。
从性质上干细胞库可分为公共库和商业自体库。公共库主要指原卫生部于2001年至2008年依据《脐带血造血干细胞库设置管理规范(试行)》等规定���,先后批准设立的北京���、天津���、上海���、浙江���、山东���、广东���、四川等7个脐带血造血干细胞库。上述干细胞库均公益为目的进行采集和存储���,供有需求的患者配型使用。另外���,国家人类遗传资源中心也设有多个间充质干细胞库。
商业自体库主要指面向社会公众从事有偿干细胞存储和制备业务的企业设立的各类干细胞库���,以新生儿自体围产组织干细胞和成人自体细胞制备及储存业务为主���,随着我国新生儿出生率的下降���,针对成人的细胞存储业务呈现明显上升趋势。以中源协和(600645)为例���,其2021年度披露的干细胞存储情况如下���:
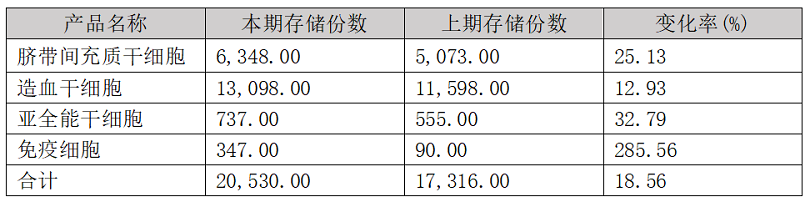
数据来源���:《中源协和细胞基因工程股份有限公司2021年年度报告》
当前全国除个别省份以外���,各省���、自治区���、直辖市���,均有对外开展细胞存储服务的企业级自体干细胞库���,其中头部的企业多采用“总部细胞库+区域细胞制备中心”模式���,在全国多个区域和省份开展干细胞存储和制备业务。
2.各类人类生物样本库
我国相关法律或行政法规并未对“人类生物样本库”的具体范畴进行明确规定���,仅在相关标准或指导性文件中有提及。如上海市临床研究伦理委员会发布的《人类生物样本库伦理审查范本》明确生物样本库“包含国家级���、省级大型生物样本库���,区域生物样本库���,医疗机构和高校���、企业生物样本库���,实验室的小型生物样本库以及储存和制备细胞和组织储存库等”。当前以下样本库类型均有可能为IPSC提供原材料(以下分类仅为讨论方便���,不视为对样本库分类标准设定)���:
(1)国家级生物样本库
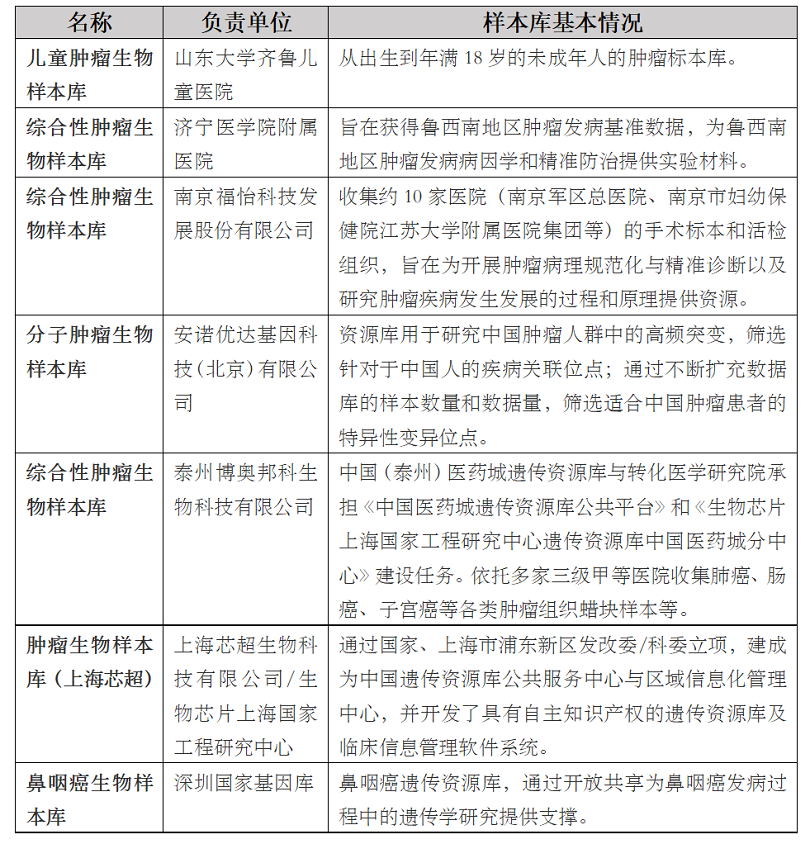
国家级样本库如国家卫生健康委科学技术研究所管理的国家人类遗传资源中心生物样本库(国科遗办审字〔2021〕BC0086号)。同时���,国家人类遗传资源中心也是国家人类遗传资源共享服务平台的管理机构���,纳入上述共享服务平台的生物样本库包括中华民族生物样本库���、国家重大疾病生物样本库���、国家生殖生物样本库���、自然人群生物样本库等7个大类样本库及几十个专题样本库。以重大疾病生物样本库中的肿瘤专题库为例���,当前纳入国家人类遗传资源共享服务平台的部分样本库如下���:
(2)省级���、区域生物样本库
区域样本库样本库多以特定省份或区域的医院临床诊疗样本资源为主���,以打通当地各医院数据孤岛���,实现当地医学样本资源共建共享为目的。如重庆市卫生健康委员会与中国科学院大学联合共建并由国科重庆转化医学研究院运行管理的重庆市医学资源样本库(国科遗办审字〔2022〕BC0023号)。
当前此类样本库在我国人类生物样本库中的占比逐渐增高。以2022年2月通过科技部保藏审批的样本库为例���,各类型代表样本库如下���:
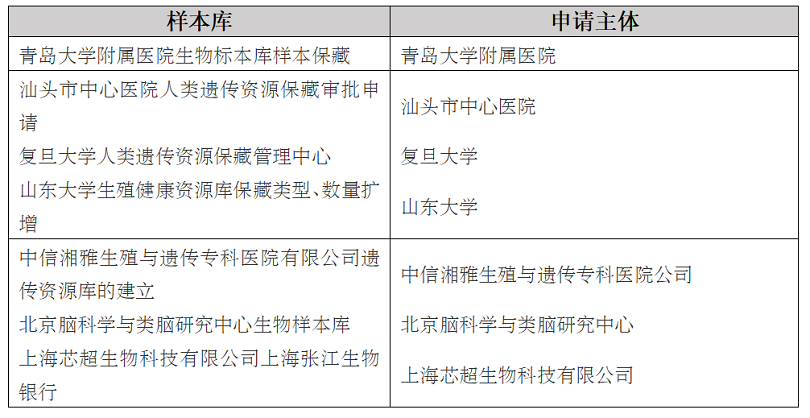
独立的第三方样本库可对外提供人类生物样本存储和保藏业务及其他技术服务。国内三方样本库以北京生命科学园生物科技研究院有限公司生物样本保藏库/北京生物银行(国科遗办审字〔2021〕BC0055号)���、上海芯超生物科技有限公司上海张江生物银行(国科遗办审字〔2022〕BC0020号)���、南京江北新区生物医药公共服务平台有限公司生物样本库(国科遗办审字〔2021〕BC0017号)���、武汉生物样本库有限公司人类遗传资源样本库的(国科遗办审字〔2022〕BC0022号)为主要代表。
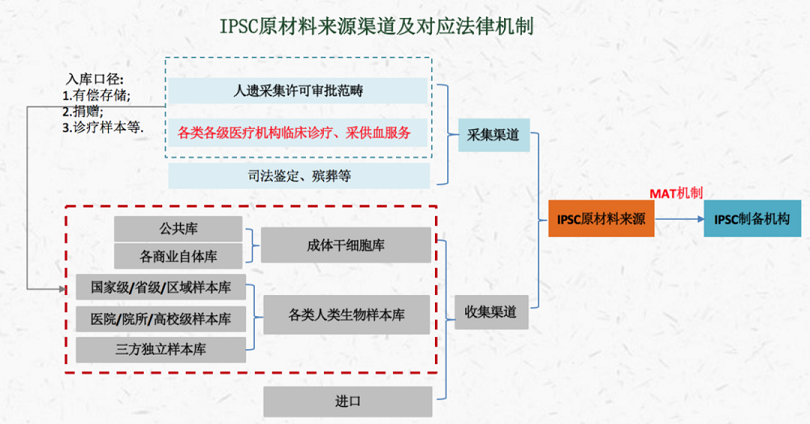
综上���,IPSC原材料采集和收集可能的来源及相关法律机制如下图���:
(三)IPSC原材料采集���、收集核心法律问题
1.成体细胞供者的溯源要求
从干细胞制剂安全性的角度���,来源合法和供者可溯源是IPSC用成体细胞的基本要求���,相关法规和规范也对此作出明确规定。如干细胞自律规范第18条规定���,如使用诱导的多能性干细胞作为干细胞的来源���,应能追溯到体细胞的供者���,并进行供者评估所需的筛查和检测;国家知识产权局2019年9月发布的《专利审查指南》也规定���,“违法获取或利用人遗资源完成的发明创造”不能被授予专利。
针对供者评估和筛查���,干细胞自律规范第15条规定���,“制备机构应建立并执行干细胞供者评估标准���,通过筛查既往病史���、家族史���、当前健康报告���,必要时还应包括出入疫区等其他情况的报告及样本检测(包括但不仅限于HIV���、HBV���、HCV���、HTLV���、EBV���、CMV���、梅毒螺旋体等)进行干细胞供者的评估���,以预防传染性疾病和明确的遗传性疾病通过干细胞制剂进行传播”。
综上���,供者筛查是干细胞产品控制风险的重要手段。尽管从技术上讲���,作为IPSC原材料的人源体细胞的来源路径广泛���,但从监管角度���,无法溯源的成体细胞或组织应当限制成为IPSC的原材料。
2.商业自体库开展干细胞存储业务的合规性评析
我国当前仅针对脐带血造血干细胞制备与存储出台了相关部门规章���,对于胎盘干细胞���、脂肪干细胞等干细胞类型的储存���,尚无无法律法规或规章进行规制。
在各地政府鼓励发展细胞治疗和生命科学产业的背景下���,从事干细胞存储与制备的企业���,多被各级科技部门���、发改部门认定为干细胞及相关领域“工程技术中心”或“工程研究中心”���,以“生物制品���、生物医药���、生物材料的研究开发���、技术咨询���、技术转让���,为医疗机构提供管理方案服务���,干细胞的储存与制备���,免疫细胞的储存与制备” 等为经营范围���,通过与医院合作���,或投建设立门诊部���、体检中心等医疗机构进行成体干细胞采集���、存储和制备活动。
即便对于有部门规章规制的脐带血造血干细胞库���,对于七大公共库之外的自体库从事存储的行为���,在司法实践中���,裁判法院也多依据《合同法》将其认定为“保管合同”,并按照合同效力的规定对存储协议的效力进行裁决。如乔某���、徐某因与江苏某生物科技有限公司消费者权益纠纷一案中���,针对乔某���、徐某该公司“未按照《脐带血造血干细胞库管理办法(试行)》规定设立���、双方签订的《干细胞制备储存技术服务合同书》应当无效”的诉请���,二审法院江苏省泰州市中级人民法院判定“《最高人民法院关于适用<中华人民共和国合同法>若干问题的解释(二)》规定合同法第五十二条第(五)项的‘强制性规定’应是效力性强制规定���,上诉人以案涉合同违反法律���、行政法规的强制性规定为由主张无效的诉请于法无据”。
因此���,我国尚待建立跨部门的干细胞和再生医学法规体系进一步明确干细胞存储业务的具体要求。
3.干细胞自体库及相关人类生物样本库的保藏许可问题
按照现行人遗条例���、《人类生物样本保藏伦理要求》(以下简称���:保藏伦理要求)及相关配套指南文件的规定���,成体干细胞���、胚胎干细胞���、作为IPSC原材料的成体细胞以及相关的组织���,属于我国人类遗传资源材料;为开展科学研究(一般包括开展临床试验���、临床药物开发试验及国际国内科研合作)进行人遗资源的保藏应当取得科技部保藏许可���,但实验室检测后按照法律���、法规要求或临床研究方案约定的临时存储行���,以及为临床诊疗���、采供血服务而进行的保藏除外;并且样本库或其母体组织���,应设立伦理委员会或接受第三方伦理委员会的指导。
尽管严格按照法律法规规定���,相关干细胞自体库和人类生物样本库应当取得科技部保藏许可���,但因作为样本库母体组织的企业设立伦理委员会可行性有限���,我国当前仅在上海���、江苏等个别地方成立了区域伦理委员会���,因此多数自体库和样本库均未申请并并获得保藏许可。上述样本库多是参照公共库相关规范或国际AABB等存储质量标准进行人遗资源存储。以上问题的解决尚待人遗监管制度的进一步明确和完善。
我们认为���,无论是否取得保藏许可或后续针对保藏许可审批的监管口径如何调整���,在我国加强人遗监管的背景下���,从事干细胞存储和人遗资源保存的企业和机构���,均应严格遵守《生物安全法》���、人遗条例���、《刑法》等法律法规中关于人遗资源出境���、国际合作���、人遗信息对外提供等监管的规定���,并针对样本的采集���、保存���、转让使用和用途等做好知情同意���,并遵守《人类生物样本库管理规范》等有关SOP要求���,控制人遗资源管理的合规风险。
4.人遗资源的产业流转与“禁止人遗资源买卖”的适用
从法律规定讲���,《民法典》第1007条规定���,禁止以任何形式买卖人体细胞���、人体组织���、人体器官���、遗体;人遗条例第10条也规定���,“禁止买卖人类遗传资源”���,同时明确“为科学研究依法提供或者使用人类遗传资源并支付或者收取合理成本费用���,不视为买卖”;保藏伦理要求在“样本的使用”部分也明确“样本不得买卖���,即样本不应产生直接经济利益���,但为科学研究提供或使用样本并支付或收取合理成本费用���,不被视为买卖”。
从产业实务讲���,人遗资源的产业化流转主要包括经采集后保存的人类样本的转让使用���,以及干细胞制剂与衍生细胞或组织的交易流转两种。
我们认为���,上述两种情况均不应简单纳入《民法典》关于“人遗买卖”的规制。对于采集后保存的样本的流转���,整体应符合“科研”和“合理成本原则”。如上海市临床研究伦理委员会《人类生物样本库伦理审查范本》第35“签订生物样本转让协议”中规定���,提供生物样本需要签订样本转让协议(material transfer agreement, MTA)���,MAT应对生物样本有清晰的描述���,明确生物样本提供者和可能涉及的相关权益和可能的使用条件���、限制可能的商业用途等;对于干细胞制剂与衍生细胞或组织的交易详见本文“IPSC及衍生细胞制备及流转涉及的法律问题”部分。
本文作者���:
声明���:
本文由k8凯发天生赢家·一触即发律师事务所律师原创���,仅代表作者本人观点���,不得视为k8凯发天生赢家·一触即发律师事务所或其律师出具的正式法律意见或建议。如需转载或引用本文的任何内容���,请注明出处。
